Nature子刊 | 复旦大学附属肿瘤医院王鲁教授及其团队联合海军军医大学王红阳院士及董立巍教授团队共同揭示肝癌治疗新策略
2023-11-06 16:53:32 来源:《Nature Communications》 医脉通编译 阅读:55次
前言: 目前,肝癌各种治疗手段“百花齐放”。其中,以酪氨酸激酶抑制剂(TKI)为代表的分子靶向药物成为晚期肝癌的主要治疗手段之一。然而,由于耐药性,很多接受TKI治疗的晚期肝细胞癌(HCC)患者的临床获益有限,亟待更多探索揭示肝癌治疗新策略。
[[[expert-person]]]
2023年10月7日,复旦大学附属肿瘤医院王鲁教授联合海军军医大学王红阳院士及董立巍教授共同通讯在《Nature Communications》上发表了题为“URI alleviates tyrosine kinase inhibitors-induced ferroptosis by reprogramming lipid metabolism in p53 wild-type liver cancers”的研究论文。该研究显示,非传统型前折叠束RPB5交互因子(URI)在HCC脂质代谢重编程中的作用,部分是通过以p53依赖性方式维持异常的硬脂酰辅酶A去饱和酶1(SCD1)表达,这反过来又促进了HCC对TKI诱导的铁死亡的抗性。研究还发现,SCD1抑制剂和TKI联合治疗有望为野生型p53和高水平URI/SCD1晚期HCC带来新希望。

肝癌领域尚存在未被满足的治疗需求
原发性肝癌是全球第六大常见癌症类型,也是癌症死亡的第三大原因。肝细胞癌(HCC)占所有肝癌病例的75-80%。据估计,大约50-60%的HCC患者,尤其是晚期HCC患者,在其一生中会接受全身治疗。近年来,以TKI为代表的全身系统治疗广泛应用于巴塞罗那临床肝癌(BCLC)分期为B期或C期的HCC患者。然而,单一的治疗方法已出现“天花板效应”,难以进一步大幅度提高疗效,亟需联合治疗手段来进一步提高疗效。其中,以靶向治疗为基础的联合模式(如靶免联合治疗)在肝癌治疗中不断获得新的突破,进一步提升了肝癌患者的临床获益。未来,将继续探寻联合治疗的“最佳拍档”,并寻找新的生物标记物以进一步提升患者临床获益。
众所周知,索拉非尼是最早用于肝癌系统抗肿瘤治疗的TKI,然而其耐药性无法避免。铁死亡作为一种独特的细胞死亡机制,在HCC的TKI治疗和耐药机制中发挥重要作用。另外,癌细胞的重编程脂质代谢不仅提供适当的能量,而且在铁死亡中起核心作用。在代谢过程中,去饱和具有重要意义。其中,SCD1活性对于维持细胞内饱和脂肪酸与不饱和脂肪酸的适当比例至关重要。既往研究发现,SCD1在一些肝癌中高表达,其抑制作用使癌细胞对索拉非尼敏感。然而,SCD1在HCC中异常表达的调控机制仍有待进一步探索。
基础研究揭示肝癌治疗新策略
研究中,研究者们首先进行了RNA测序(RNA-seq)分析以表征URI依赖性转录组改变。结果发现,在shRNA(Ctrl)和shURI HepG2细胞之间共有1676个基因差异表达。使用京都基因和基因组百科全书(KEGG)途径进行的功能富集分析显示,铁死亡是URI调节的最大改变途径之一(图1a)。铁死亡相关基因的表达随着URI敲低而增加。基因集富集分析(GSEA)显示,与对照组相比,shURI细胞中的铁死亡(而非细胞凋亡信号传导)呈正富集(图1b)。这些结果表明,URI可能在铁死亡中起重要作用。同时,包括EGFR TKI耐药、脂解调节、p53信号通路和癌症转录错误调节在内的通路也受到URI的调控(图1a)。
目前,已经有多项临床试验评估了TKI治疗晚期HCC的效果。与细胞毒性作用一致,这些TKI有效地降低了测试的各种癌细胞系中的肿瘤活力(图1c)。值得注意的是,以B-RAF为共同靶标的索拉非尼,瑞戈非尼和多纳非尼有利于铁死亡样细胞死亡,而其他测试药物对细胞脂质过氧化几乎没有影响(图1d)。
表1治疗晚期HCC的TKI

然后,研究者测试了URI是否调节TKI诱导的细胞毒性。用增加浓度的索拉非尼处理JHH1和HepG2细胞48小时,并评估细胞增殖。URI耗竭显著增加了JHH1和HepG2细胞对索拉非尼的敏感性,JHH1细胞的IC50(引起50%的活力抑制)从8.324μM(Ctrl)降低到6.480μM(shURI),HepG2细胞的IC50(引起50%的活力抑制)分别从8.047μM(Ctrl)降低到4.069μM(shURI)(图1e)。在HepG2-shURI和对照细胞之间,也发现了对瑞戈非尼或多纳非尼的类似剂量效应曲线模式。克隆形成测定证实了URI在索拉非尼耐药中的作用(图1f,g)。有趣的是,JHH1和HepG2细胞中的URI敲低显著增加了索拉非尼诱导的脂质过氧化(图1h),表明URI可能抑制TKI诱导的铁死亡。
此外,当采用抗氧化剂N-乙酰半胱氨酸(NAC)或铁死亡抑制剂铁抑素-1预处理时,索拉非尼诱导的URI敲低细胞的细胞毒性作用可以被拯救,而细胞凋亡、坏死或自噬抑制剂几乎没有影响(图1i)。URI耗竭也增强了RSL3(一种GPX4抑制剂)诱导的铁死亡。这些结果表明,URI与肝癌细胞中对TKI诱导的铁死亡的抵抗有关。
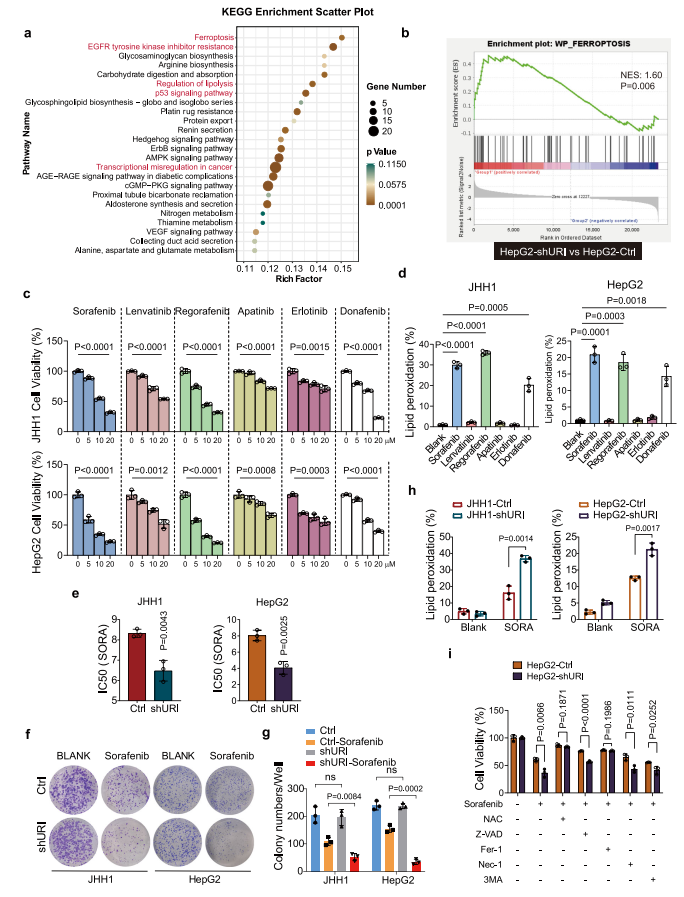
图1 URI耗竭促进TKI诱导的癌细胞铁死亡
总体而言,URI以TRIM28-MDM2依赖的方式保持低水平的p53,维持SCD1活性和MUFAs的积累,随后促进癌细胞对TKI的耐药性。URI-p53-SCD1轴介导了TKI的耐药,并可能解释了为什么p53 野生型HCC仍然显示出对TKI的内在抗性。此外,对于约41%的野生型p53和高水平URI/SCD1的晚期HCC患者,联合治疗可能是一种有前景的治疗策略。
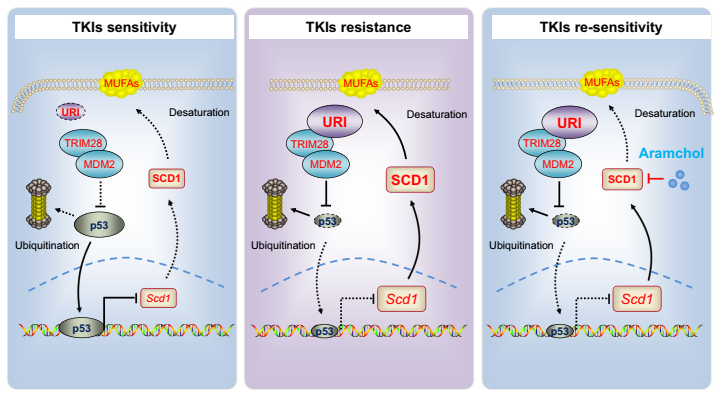
图2 URI-p53-SCD1轴介导TKIs耐药和施用aramchol肝癌细胞对TKI再敏的模型




